日本卡一卡二卡三入口:youjizi-为溶血性疾病治疗提供新靶点,专家团队在《细胞》发文
原本应该“寿终正寝”的“氧气快递员”红细胞,却纷纷意外死亡——溶血性疾病轻则导致疲劳、贫血,重则引发器官衰竭,原因何在?
针对这一问题,华东理工大学教授刘琴团队联合空军军医大学附属西京医院副教授胡兴斌团队,揭示了一种红细胞程序性死亡的新机制。北京时间4月18日,国际期刊Cell(《细胞》)以“Red blood cells undergo lytic programmed cell death involving NLRP3”为题,发表了这一研究成果。

《细胞》期刊发表华理联合团队最新成果。 本文图片均为 华东理工大学 供图
该项成果首次揭示补体系统激活触发红细胞程序性死亡的新机制——血影蛋白依赖性死亡(spectosis),为溶血性疾病及炎症性疾病的治疗提供了全新药物靶点,不仅有助于人类疾病治疗,未来也可拓展至畜禽、水产养殖业感染性病害防控领域。
作为机体氧气运输的核心载体,红细胞负责将血液里的氧气输送到各个器官,同时参与免疫调控。正常人体内的红细胞寿命平均为120天,但在病理状态下,免疫系统就可能会错误识别红细胞,“认友为敌”发起攻击,激活补体系统这一重要免疫防御机制,由此产生的膜攻击复合物会在红细胞表面“打孔钻洞”,从而破坏细胞完整性,最终导致溶血。
研究人员介绍,针对溶血性疾病,当前临床应用的补体抑制剂虽然能延缓溶血,但是细胞破坏过程一旦启动,这些抑制剂也将回天乏术,而且单靶点治疗效果也受限。因此,解析补体攻击引发的红细胞内部分子事件,开发针对性干预策略,成为提升疗效的关键突破口。
研究团队通过构建补体激活诱导溶血的体外模型发现,补体信号的激活会依次引发红细胞的程序化形态重塑,并伴随着细胞内容物的外排等变化。这就提示该过程可能存在程序性死亡机制。
为了验证这一机制,团队进一步采用NLRP3和caspase-8特异性激活剂/抑制剂进行干预实验。研究首次证实,补体激活可触发红细胞内miniNLRP3-ASC-caspase-8信号通路级联反应,继而介导下游核心作用靶点血影蛋白β亚基(β-spectrin)的酶切裂解。作为维持细胞膜骨架的重要组成部分,β-spectrin的酶切降解直接导致膜骨架解体,由此引发溶血。研究团队将这一新型程序性死亡方式命名为“spectosis”。
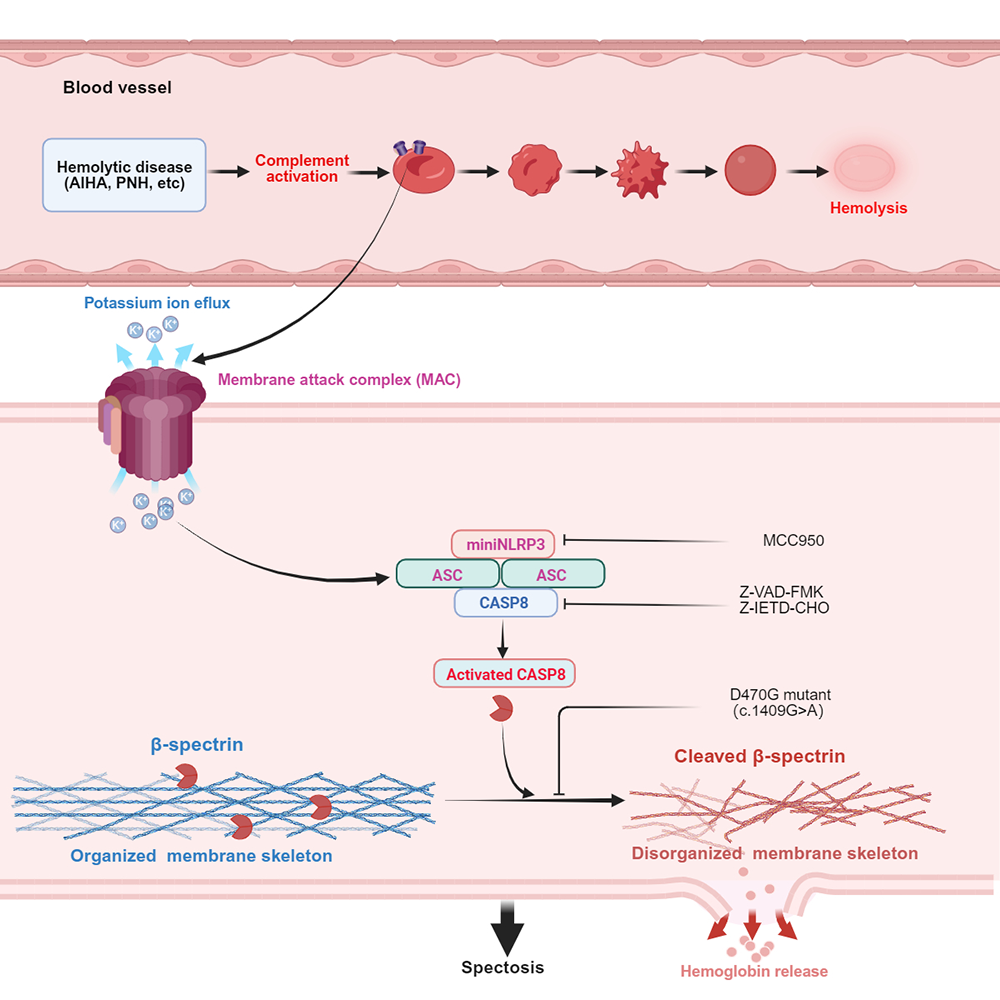
补体信号途径介导spectosis的分子机制
“spectosis定义了一种红细胞程序性死亡新机制,对于溶血性疾病的诊断和治疗至关重要。”刘琴介绍说。
科学构想提出后,研究团队又通过体内外机制进行了深度验证。在动物实验中,研究团队构建了急性溶血性输血反应的小鼠模型,成功再现补体依赖性溶血进程,相关实验从遗传学角度验证spectosis的核心机制。
为了评估spectosis通路关键靶标的治疗价值,研究团队采用补体信号C3抑制剂和NLRP3炎症小体抑制剂进行干预,发现两种药物联合使用“协同增效”,显示出“1+1>2”的治疗效果。
“这项研究不仅系统阐明spectosis信号通路的分子机制,更创新性提出‘补体抑制+细胞死亡阻断’的联合治疗方案。”刘琴教授介绍说,相较于现有单靶点治疗,这种“双管齐下”的策略可突破补体系统代偿激活的瓶颈,为溶血性疾病治疗开辟有效途径。
目前,研究团队已着手建立以红细胞spectosis为核心的药物筛选平台,首批筛选的药物分子在养殖鱼类感染性肠炎的口服治疗中表现出良好效果。“未来,我们将和药学专业教授紧密合作,精准筛选靶向抑制补体激活及炎症小体活化的药物分子,为炎症性疾病药物开发贡献力量。”刘琴说。
该论文由华东理工大学生物工程学院、生物反应器工程全国重点实验室陈守文副研究员、刘琴教授与西京医院胡兴斌副教授共同指导完成,香港中文大学(深圳)、上海奥浦迈生物科技股份有限公司提供技术支持。研究获国家重点研发计划、国家自然科学基金等项目资助。







