界面新闻记者 |
界面新闻编辑 | 谢欣
2021年,随着“童颜针”、“少女针”等产品在国内获批上市,这一年也被称为中国医美行业的“再生元年”。医美行业从业人员刘伟(化名)对界面新闻记者表示,经过最近几年市场教育知晓度及销量大幅度增加以及严肃医疗集采,很多药企以及投资方开始转投医美项目。
但医美产品同质化泛滥,资方急需打造一款新品相。羟基磷灰石是人体和动物骨骼的主要无机成分,能参与体内代谢、促进缺损组织的修复,具有很好的生物相容性和生物可降解性,于是,原本广泛应用于骨科和牙科的羟基磷灰石“脱颖而出”,成为再生医美新宠。
在小红书搜索“羟基磷灰石”可以看到,已经有不少人在脸上注射羟基磷灰石产品,主要产品包括上海睿星的悦龄塑、成都睿合的菲林普利、昊海生科的海魅云境。

然而,目前以医美适应症获批的羟基磷灰石现阶段仍处于空缺状态,医美市场上用于面部填充的羟基磷灰石大多是在打“擦边球”。
近日,界面新闻接连收到业内流传的关于羟基磷灰石及医美产品合规使用的通知。其中最新通知显示,1月21日,广东相关监管部门将召开集体约谈会议,对辖区内医疗美容机构进行培训,并要求各参会企业签订集体约谈责任书。
灰色地带
2021年,悦龄塑、菲林普利率先上市,2023年,海魅云境上市。在小红书账号上,悦龄塑将自己描述为“填充塑型+骨老化修复......可降解的再生材料”;据菲林普利公众号文章,菲林普利有L/M/S三款再生抗衰品项,“有效治愈肌肤衰老”;海魅云境在上市发布会上公布定位为高定塑形。
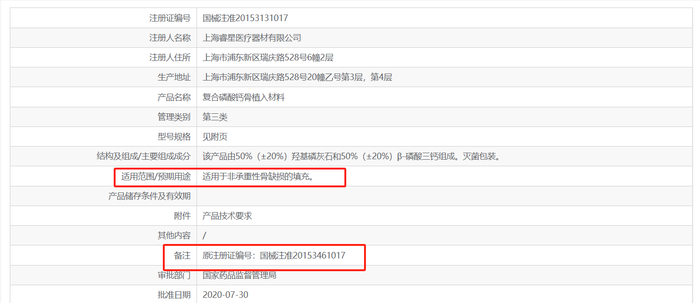
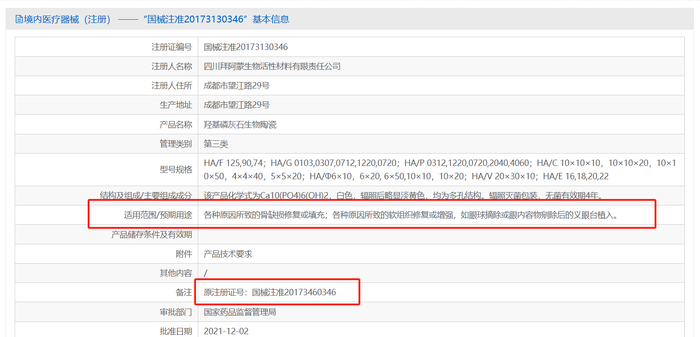
但实际上,这三款产品在国家药监局获批的适应症并非医美相关适应症。据国家药监局官网,悦龄塑产品名称为“复合磷酸钙骨植入材料”,适用范围为“非承重性骨缺损的填充。”;菲林普利由四川拜阿蒙生物材料公司研发生产,产品名称为“羟基磷灰石生物陶瓷”,适用范围为“各种原因所致的骨缺损修复或填充;各种原因所致的软组织修复或增强,如眼球摘除或眼内容物剜除后的义眼台植入。”;海魅云境由上海倍尔康生物医学科技有限公司生产,产品名称为“羟基磷灰石生物陶瓷”,适用范围为“适用于非承重性骨缺损的填充。”
值得注意的是,悦龄塑和菲林普利的原批件早在2015年和2017年就已经获批,却都恰好选在2021年再生产品爆发之年推出医美品牌。
刘伟对记者表示,再生类产品审批周期过长,不考虑研发及检测,一般仅临床+注册可能需要3-4年。而羟基磷灰石类产品的骨科及口腔科适应症大约有200个左右的注册证,该分类目录下产品多数只需要同品种对比即可上线。
相较而言,整形填充注射产品都需要进行临床试验,且需要明确注射层次及部位。刘伟表示,目前超适应症使用的羟基磷灰石类产品多数没有进行规范的生物相容性试验及临床试验等相关数据的收集,注射层次也不同,安全性存在风险。
但是,联合丽格医疗美容集团创始人、董事长李滨认为,羟基磷灰石是一种带有刺激性再生功能的填充剂,如鼻基底凹陷、面部骨量流失、面部下垂等面部适应症也属于非承重性骨缺损的范畴,只要与获批适应症相关联就能够使用。
李滨表示,在医美行业里,医疗器械超适应症使用的现象极其普遍,此前大火的肉毒素、玻尿酸等产品也经常超适应症使用。
超适应症使用主要是因为产品新适应症的获批往往要经过漫长的临床试验和审批过程,不少厂家为了产品能够快速在市场中打响知名度,打起了“擦边球”。
一些骨科产品获批的适应症描述相比整形美容用的注射填充物很模糊,比如“非承重性骨缺损的填充”、“各种原因所致的骨缺损修复或填充”并未明确用于什么部位和层次。而整形美容用的填充物都会明确注射部位和层次。如某进口产品:该产品用于面部骨膜上注射,以改善中度下颌后缩患者的下颌轮廓。
但从产品注册的角度,国家要求产品根据相关分类目录进行申报。比如,依据《医疗器械分类目录》,整形美容用重组人源化胶原蛋白注射材料的管理类别为Ⅲ类,分类编码13-09-02;而骨科填充及修复产品的分类编码为13-05、口腔科产品的一级产品类别以17为开头。2020年9月30日,国家药监局医疗器械标管管理中心发布的《2020年第二批医疗器械产品分类界定结果汇总》中将羟基磷灰石微球的医疗美容产品归类为III类医疗器械进行管理,分类编码为13-09。
据国家药监局官网,悦龄塑、菲林普利及海魅云境的分类编码均为13-05-02,归属于骨科填充及修复产品中的钙盐类骨填充植入物。《钙磷/硅类骨填充材料注册技术审查指导原则》中指出,该类填充材料适用于骨科创伤以及手术引起的不影响骨结构稳定性的骨缺损的填充,即四肢和脊柱的非结构性植骨。
而此前获批上市的童颜针、少女针的分类编码为13-09-02。比如,圣博玛的艾维岚®,产品名称为聚乳酸面部填充剂,在国家药监局获批的适应症明确为“适用于注射到真皮深层,以纠正中重度鼻唇沟皱纹”,分类编码为13-09-02。
刘伟对记者表示,厂家对机构的宣传不会说明产品的具体分类,因此从机构角度而言,有些产品确实不容易分辨合规性。
首款合规产品在路上
用于骨科和医美的羟基磷灰石有何区别?羟基磷灰石是人体和动物骨骼的主要无机成分,能参与体内代谢、促进缺损组织的修复,具有很好的生物相容性和生物可降解性,已广泛应用于医疗领域;由于微球注射入皮下后具备刺激胶原蛋白再生的效果,后被应用于医疗美容领域。
然而,医美用的羟基磷灰石一般粒径几十微米,形似表面光滑的微球,可以减少注射过程中的皮肤创伤和严重副作用。而骨科/牙科用的羟基磷灰石多为几百微米的多孔不规则颗粒,也被称为骨粉。骨粉注射到人体后会变得坚硬,难以被人体溶解,属于一种不可逆转的注射物。
国内产品,如菲林普利在宣传其产品也提及,其核心成分为粒径位于20-70微米的中空多孔CaHA微球。
至于获批用于骨科及牙科的羟基磷灰石产品能否用于医美,无法简单下定论。在国内,无论是骨科、牙科还是医美产品,均属于第三类医疗器械,尤其是医美整形填充注射产品要进行相关临床试验,收集不良反应数据才能判断其安全性。
不过,羟基磷灰石可用于医美已得到验证。根据多位医生2018年发布的《注射稀释和超稀释羟基磷灰石钙用于皮肤紧致的全球共识》,未稀释的羟基磷灰石具备较高粘弹性,适合深层植入和容积补充,而通过利多卡因或盐水稀释后的羟基磷灰石更适合注射至浅层且更易扩散,可以改善中下面部、颈部、颈下三角区、上臂、腹部、大腿和臀部的皮肤松弛和皮肤质量。
欧美已有适用于医美的羟基磷灰石产品获批。2006年, Radiesse(瑞德喜)获批用于减轻面部鼻唇沟皱纹,2015年添加利多卡因版本的注射剂获FDA(美国食药监局)批准上市,后于2021年增加了用于深层注射以及改善颌部轮廓缺失的适应症。信达证券统计,自2006年上市以来,瑞德喜已经进入全球57个国家或地区、销售支数超1000万支,且为当前唯一一款经FDA批准的羟基磷灰石医美注射剂。
2022年4月,艾尔建在美容与抗衰老医学世界大会 (AMWC)发布核心成分为透明质酸和羟基磷灰石的HArmonyCa,目前获得欧盟CE认证,进入以色列、巴西以及部分欧盟国家市场。
就国内市场而言,多家企业正在竞争首张羟基磷灰石在医美面部填充领域的合规证件。2023年瑞德喜启动“纠正中重度鼻唇沟皱纹”适应症的国内注册临床;2024年9月艾尔建宣布,旗下的HArmonyCa已在中国完成注册检验,即将展开临床试验。早先在2024年2月,艾尔建的HArmonyCa已经在中国香港地区上市。
目前,国内企业进展较快的是获得丸美股份投资的摩漾生物,其核心产品魔颜微晶——注射用羟基磷酸钙面部填充剂已临近上市,有望成为该材料在中国医美面部软组织注射填充领域的合规首证。
此外,截至2024年10月,上海璞聚生物的羟基磷灰石产品Rejuve已完成近200例注册临床试验入组,且已经获得超过半年的随访。








